¿COMO SE FORMAN LOS COMPUESTOS QUÍMICOS EXISTENTES EN LA NATURALEZA?
Los compuestos químicos que se encuentra en el mundo surgen por diferentes factores que se encuentran en la naturaleza, cada átomo posee una cantidad especifica de electrones/protones/neutrones y al estar en un ambiente en contacto con otros elementos naturalmente se generan transformaciones sencillas que dan origen a los compuestos. Como ejemplo se podría usar cualquier elemento natural, en este caso el Cloruro de sodio (NaCl)
1.Qué entiendes por enlace
químico?
Es la fuerza que mantiene unidos a
los atomos de los elementos químicos cuando se forma la molecula de un
compuesto
2. Identifique y defina las
propiedades que debe tener todo enlace químico para su formación?
Las propiedades del enlace químico son:
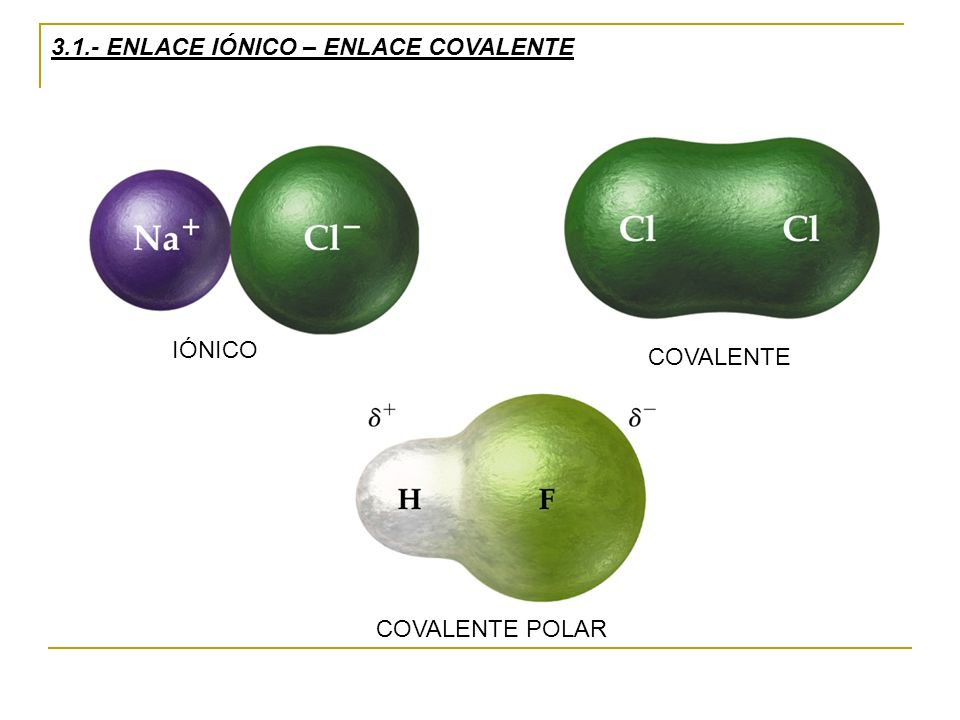
- ENLACE IÓNICO

Es la unión de un metal y un no metal, ya que el enlace iónico se produce entre átomos de elementos que poseen electronegatividades muy diferentes. El elemento de menor energía transfiere los electrones, mientras que el de mayor los coge.
- POTENCIAL DE IONIZACIÓN
Es la cantidad de energía mínima necesaria para separar un electrón (el más débil) de un átomo o molécula esta cantidad de energía puede aumentar dependiendo del elemento.
- ELECTRONEGATIVIDAD
Es la capacidad que tienen los átomos de atraer y retener los electrones que participan en un enlace químico.
- AFINIDAD ELECTRÓNICA
La afinidad electrónica se define como la energía liberada cuando un átomo gaseoso neutro captura un electrón y forma un ion mono-negativo.
- CARÁCTER METÁLICO
Se define como una transición gradual en el carácter de los elementos, el cual se basa en el nivel metálico de cada uno de los mismos, ya que estos son poco electronegativos (ceden electrones fácilmente). En la tabla periódica se puede observar este cambio de derecha a izquierda y de arriba hacia abajo.
- VOLUMEN ATÓMICO
El volumen atómico es una medida que da idea del espacio que ocuparía un átomo de dicho elemento, depende de su estado de agregación, se mide en unidades de volumen por mol.
- VALENCIA IÓNICA
Con la valencia iónica nos referimos a la cantidad de electrones necesarios en un átomo para lograr completar su último nivel ya sean que le falte o sobren.
·
3. Qué diferencia encuentras
entre número de oxidación y valencia de un elemento?
La valencia son los
electrones que ese átomo pone en juego en un enlace. Son los electrones que se
ganan, pierden o comparten. La valencia a diferencia del número de oxidación,
no tiene signo.
El número o estado de oxidación tiene signo porque considera a las uniones como iónicas por lo tanto es positivo si el átomo pierde electrones o los comparte con un átomo que tenga tendencia a ganarlos ( más electronegativo). Es negativo si el átomo gana electrones. La tendencia a ganar o perder depende de cuantos electrones tengan en el último nivel por cuanto los átomos reaccionan para alcanzar la configuración de un gas noble por ser ésta más estable.
Los metales por lo tanto tienen números de oxidación positivos porque tienden a ceder electrones.
Los no metales por el contrario tienen números de oxidación negativo porque en una unión iónica tienden a ganar electrones.
El número o estado de oxidación tiene signo porque considera a las uniones como iónicas por lo tanto es positivo si el átomo pierde electrones o los comparte con un átomo que tenga tendencia a ganarlos ( más electronegativo). Es negativo si el átomo gana electrones. La tendencia a ganar o perder depende de cuantos electrones tengan en el último nivel por cuanto los átomos reaccionan para alcanzar la configuración de un gas noble por ser ésta más estable.
Los metales por lo tanto tienen números de oxidación positivos porque tienden a ceder electrones.
Los no metales por el contrario tienen números de oxidación negativo porque en una unión iónica tienden a ganar electrones.
Ejemplos
Fe2O3
Valencia hierro: 3
Valencia oxigeno :2
Numero de oxidación hierro:+3
por que pierde 3 eletrones
Numero oxidación oxigeno:-2
porque cada oxigeno gana 2 electrones
4. Cuales son los diferentes tipos de enlaces que
existen definalos y de ejemplos?
·
Es la fuerza de atracción eléctrica que existe entre los iones de cargas opuestas (cationes - aniones) que los mantienen juntos en una estructura cristalina.
Resulta de la transferencia de uno o más electrones comúnmente del metal hacia el no metal
Ejemplo: Cloruro de Sodio (NaCl)
Si los átomos del enlace pertenecen a los metales este se denomina "enlace metálico" en este caso los electrones son compartidos por los átomos pero aún así pueden moverse a través del sólido aplicando conductividad térmica o eléctrica, ductilidad o maleabilidad.
Los electrones que hacen parte de dicho enlace se mueven libremente por la poca fuerza de atracción del núcleo sobre los electrones en los extremos
Ejemplos: Alnico (Niquel, Cobalto y Aluminio)
Se produce entre dos àtomos o grupos de àtomos cuando estos se unen para alcanzar el octeto estable entonces comparten electrones del último nivel pero la diferencia de electronegatividades entre los àtomos no es los suficientemente grande como para que se produzca una unión de tipo iónica, en cambio, solo es posible compartir los electrones con el fin de alcanzar la mayor estabilidad posible.
Ejemplo:
En un enlace covalente polar uno de los átomos ejerce una atracción mayor sobre los electrones de enlace que otro. Esto depende de la electronegatividad, cuando la diferencia de electronegatividad está entre 0,5 y 2,0 la desigualdad con que se comparten los electrones no es tan grande como para que se produzca una transferencia completa de electrones. Se denomina "polar" debido a que al compartir desigualmente los electrones se generan dos polos a través del enlace
Este es el tipo de enlace que se hace entre una misma clase de átomos.
Ejemplo: Metano (CH4) | |




No hay comentarios:
Publicar un comentario